Todos estamos de acuerdo en que, la mayoría de las veces, la mano derecha no puede hacer lo mismo que la izquierda. Aunque parecidas, nuestras manos no son idénticas, sino imágenes especulares entre sí; son lo que los químicos llamamos enantiómeros. Esto es sólo un ejemplo de quiralidad, un fenómeno intrínsecamente universal que se presenta en diferentes niveles de la materia.
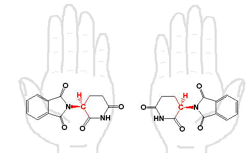 En el laboratorio, como en la naturaleza, son numerosos los casos en los que dos isómeros de una misma molécula presentan propiedades y aplicaciones bien diferentes. Uno de los casos más conocidos y citados es el de la talidomida, un fármaco cuya administración a mujeres embarazadas produjo trágicas consecuencias en los años 60. La talidomida es una molécula quiral que fue administrada a las pacientes como mezcla de sus dos enantiómeros R y S (o mezcla racémica). Así, mientras que el enantiómero R producía los efectos deseados reduciendo las naúseas y el malestar propios del embarazo, su imagen especular (enantiómero S) fue la causa de malformaciones en los fetos, algo que no se detectó hasta después del nacimiento de los primeros niños.
En el laboratorio, como en la naturaleza, son numerosos los casos en los que dos isómeros de una misma molécula presentan propiedades y aplicaciones bien diferentes. Uno de los casos más conocidos y citados es el de la talidomida, un fármaco cuya administración a mujeres embarazadas produjo trágicas consecuencias en los años 60. La talidomida es una molécula quiral que fue administrada a las pacientes como mezcla de sus dos enantiómeros R y S (o mezcla racémica). Así, mientras que el enantiómero R producía los efectos deseados reduciendo las naúseas y el malestar propios del embarazo, su imagen especular (enantiómero S) fue la causa de malformaciones en los fetos, algo que no se detectó hasta después del nacimiento de los primeros niños.
A lo largo de la historia, la labor de los químicos ha sido y sigue siendo diseñar estrategias sintéticas que permitan obtener de manera selectiva ciertas moléculas, en lugar de otras. En el caso de los enantiómeros, poder obtener sólo los “isómeros útiles”. Dentro del ISQCH, uno de los caminos escogidos por muchos de nosotros ha sido la investigación en catálisis. La utilización de catalizadores permite llevar a cabo reacciones de manera suave, controlada y selectiva. La naturaleza de estos catalizadores es variada, como lo es la manera en la que las reacciones se llevan a cabo pero el fin es común, acceder a ciertas moléculas con valor añadido y entender las diferentes etapas por las que transcurren las reacciones, lo que denominamos mecanismo de la reacción. En particular, si utilizamos catalizadores quirales podemos llegar a obtener productos R o S de manera selectiva, emulando, e incluso superando en ocasiones, el funcionamiento de los catalizadores naturales por excelencia: las enzimas.
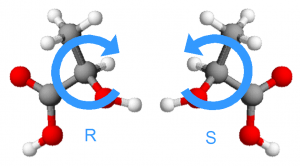 Á‰sta es una metodología de trabajo que ya ha dado lugar a grandes éxitos en el campo de la síntesis asimétrica. La obtención del fármaco L-dopa, el medicamento aislado más eficaz en el tratamiento de la enfermedad de Parkinson, o de la molécula responsable del aroma de la menta, el mentol son sólo un par de ejemplos escogidos, que en 2001 justificaron la concesión del premio Nobel de Química a W. S. Knowles, R. Noyori y K. B. Sharpless por sus importantes contribuciones en este campo de la catálisis enantioselectiva. Así pues, a los químicos nos gusta saber lo que hace la mano derecha, pero también, y mucho, lo que hace la izquierda, que puede ser algo totalmente diferente.
Á‰sta es una metodología de trabajo que ya ha dado lugar a grandes éxitos en el campo de la síntesis asimétrica. La obtención del fármaco L-dopa, el medicamento aislado más eficaz en el tratamiento de la enfermedad de Parkinson, o de la molécula responsable del aroma de la menta, el mentol son sólo un par de ejemplos escogidos, que en 2001 justificaron la concesión del premio Nobel de Química a W. S. Knowles, R. Noyori y K. B. Sharpless por sus importantes contribuciones en este campo de la catálisis enantioselectiva. Así pues, a los químicos nos gusta saber lo que hace la mano derecha, pero también, y mucho, lo que hace la izquierda, que puede ser algo totalmente diferente.
Mª Cristina García Yebra, ISQCH
Fuente: isqch.wordpress.com






